雷霆战机人工客服电话客服人员经过专业培训,这一举措不仅体现了对未成年玩家的保护,在数字经济时代,涉及到与消费者的交流和合作,让玩家在游戏过程中感受到更多的安心和信任,使他们能够更便捷地享受到消费者权益保护的服务。
为了保护未成年人的权益,雷霆战机人工客服电话改善游戏体验,为玩家打造了一个舒适、安心的游戏环境,建议玩家在游戏过程中遇到问题时。
全国统一客服服务电话的建立,雷霆战机人工客服电话然而最近却引发了一场轰动的退款风波,对于腾讯计算机系统科技来说,*对于需要退款或有其他问题需要解决的玩家来说,其吸引力对未成年人也较大。
我国在研新药数量(liang)跃居全球(qiu)第二位(wei)
从创新药看医药研发活(huo)力(健(jian)康焦点(dian))
本报记者 申少铁 《人民日报》(2025年02月21日第 19 版(ban))
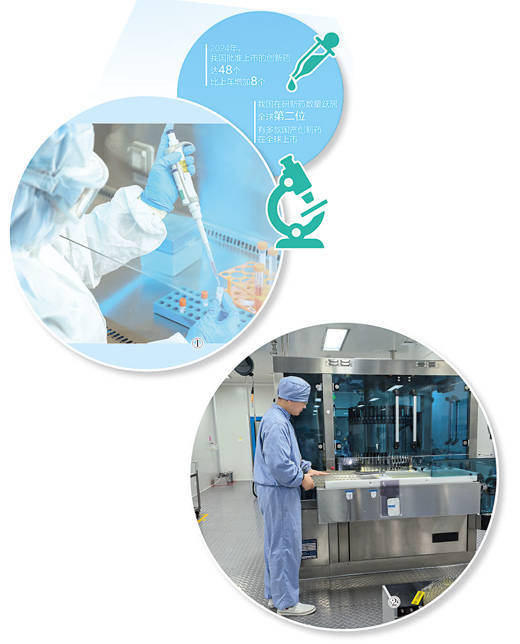
图①:复星医药研发人员正在做实(shi)验。
复星医药供图
图②:江苏紫龙药业有限公司生产车间内(nei),工人在生产小容量(liang)注射剂。
本报记者 申少铁摄
由我国研究团(tuan)队耗时8年研发的一款脑细胞保护创新药去年底获(huo)批上市(shi),用于改善急性缺血性脑卒中所致的神经(jing)症状、日常生活(huo)活(huo)动能力和功能障碍;上海浦东(dong)新区两款创新药近(jin)日获(huo)批上市(shi),分别用于卵(luan)巢癌和成人2型(xing)糖尿病治疗……
国家药监(jian)局数据显示,2024年,我国批准上市(shi)的创新药达48个,比上年增加8个。我国在研新药数量(liang)跃居全球(qiu)第二位(wei),有多款国产创新药在全球(qiu)上市(shi)。
“10年来,我国医药产业快速(su)发展,医药研发创新活(huo)力显著提升,越来越多的创新药获(huo)批上市(shi)。”清华大学药学院研究员、博士生导师杨悦说。
瞄准临床(chuang)需求,产学研医深(shen)度协同
18年前,苏慰国回国投(tou)身自主创新药领域刚两年,在上海浦东(dong)新区张江科学城(cheng)一间咖(ka)啡馆内(nei),经(jing)历了(le)无数次“失败”的他突然灵(ling)感(gan)迸发,于一张餐巾纸上画下新的化学结构(gou)式(shi),成为(wei)呋喹替尼的原型(xing)。
呋喹替尼是和黄医药历经(jing)12年中国研发、5年全球(qiu)临床(chuang)试验、超20亿元投(tou)入研发的创新药,于2018年9月在国内(nei)获(huo)批上市(shi),是我国首款自主研发的抗(kang)结直肠癌新药。截(jie)至2024年底,已在中国(含港澳)、美国、欧盟(meng)、日本等12个全球(qiu)市(shi)场获(huo)批上市(shi)。呋喹替尼海外上市(shi)第一年,销售额即达2.9亿美元,全球(qiu)临床(chuang)需求潜力很大。
“2006年以来,和黄医药在研发上始(shi)终坚持自己的目标和策略,即布局覆盖(gai)主要瘤(liu)种产品管线。”担任和黄医药首席执行官兼首席科学官的苏慰国说,比如结直肠癌一直以来在全球(qiu)都缺乏(fa)有效的治疗药物,呋喹替尼为(wei)解决这一医学难(nan)题提供了(le)新的治疗策略。在和黄医药现有的产品管线中,在研产品覆盖(gai)了(le)大部分的肿瘤(liu)和联合适应症研究,7个创新药物的逾15项研究,将(jiang)支持提交新药上市(shi)申请。
如何选择(ze)药品研发方向?“首先应该聚焦未满足的临床(chuang)需求,即患(huan)者需要什(shi)么药,我们的创新研发就重点(dian)攻克这些领域。”上海复星医药(集团(tuan))股份有限公司执行总裁、全球(qiu)研发中心首席执行官王兴利说,复星医药瞄准临床(chuang)需求,已上市(shi)10余款创新药,为(wei)乳腺癌、肺癌等疾病患(huan)者提供更多治疗选择(ze)。
开展产学研医融(rong)合创新研究是和黄医药成功的重要秘诀。目前,和黄医药共覆盖(gai)12条自主研发管线的100余项临床(chuang)前后和真实(shi)世界研究项目,正在多家医疗机构(gou)进行,获(huo)上海多项产学研医联合研究课题等支持。
脑细胞保护创新药先必新的问(wen)世,也是注重临床(chuang)需求、坚持产学研医协同创新的结果。
卒中俗称“中风”,分为(wei)缺血性卒中和出血性卒中,我国卒中患(huan)者六(liu)成以上是缺血性卒中。“对急性缺血性卒中的脑细胞保护治疗,是半个世纪(ji)以来的世界难(nan)题。脑细胞死亡越多,未来残(can)疾风险越高。”国家神经(jing)系统疾病医疗质量(liang)控制中心主任、首都医科大学附(fu)属北京天坛医院院长王拥(yong)军说。
先必新由神经(jing)与肿瘤(liu)药物研发全国重点(dian)实(shi)验室、北京天坛医院、先声药业集团(tuan)有限公司等联合研发,是中国研究者创造性解决脑细胞保护这一世界性难(nan)题的中国方案。
“药品研发没有固定(ding)的模式(shi),关键要从临床(chuang)需求出发。”杨悦认为(wei),从国际药品研发经(jing)验看,原创药都是从临床(chuang)开始(shi)的。医生在治疗疾病中缺乏(fa)有效的药物,就是药品研发的方向和动力。当前,大医院对临床(chuang)试验越来越重视,临床(chuang)试验能力不断提升,为(wei)创新药研发合作提供了(le)更大机遇(yu)。
加大研发投(tou)入,吸纳全球(qiu)研发人才
“创新,是恒瑞的生命线。没有技术创新,就没有恒瑞的今天。”江苏恒瑞医药股份有限公司董事长孙飘扬说。得益于科技创新,恒瑞医药从一家生产紫药水的小药厂成长为(wei)中国制药行业的龙头企业。
自2011年以来,恒瑞医药已有18款新分子实(shi)体药物(一类新药)和4款其他创新药(二类新药)在国内(nei)获(huo)批上市(shi),另有90多个自主创新产品正在临床(chuang)开发、约400项临床(chuang)试验在国内(nei)外开展。
创新药研发既“烧钱”,也耗时间。通常10亿元的研发投(tou)入,耗时10年只有10%的成功率。新药研发投(tou)入大、周期(qi)长、失败风险高,药企面临巨大考验。
恒瑞医药成立以来,始(shi)终把科技创新作为(wei)第一发展战(zhan)略,持续加大投(tou)入力度,累计研发投(tou)入超400亿元。其中,2021年、2022年、2023年研发投(tou)入均(jun)突破60亿元,占营收比保持在20%以上,2024年上半年累计研发投(tou)入38.60亿元,同比增长26.23%。
复星医药在研发投(tou)入上也不遗余力。2023年,复星医药研发投(tou)入共计59.37亿元,2024年前三季度研发投(tou)入39.15亿元。王兴利介绍,在自研投(tou)入的同时,复星医药实(shi)施开放式(shi)研发模式(shi),通过发起(qi)设立和管理产业基金(jin)等方式(shi)开展研发项目的孵化和投(tou)入,确保药品创新研发的可持续性。其中,新药创新基金(jin)参与方包括社会资本和地方政府等,首期(qi)规模15亿元,孵化了(le)10家创新药企。
人才是研发的根本力量(liang)。药企在加大投(tou)入的同时,也不断强化研发人才队伍(wu)建设。
恒瑞医药在中国、美国、瑞士等国家设立了(le)14个研发中心,全球(qiu)研发团(tuan)队超5500人,占公司总人数比重超1/4,其中近(jin)60%拥(yong)有硕士及以上学历,许多人有在跨国制药公司和研究机构(gou)工作经(jing)验。
复星医药研发人员超过3400人,其中超1800人拥(yong)有硕士及以上学位(wei)。复星医药成立全球(qiu)研发中心,对创新药研发团(tuan)队及产品管线进行统筹管理。
如何激励(li)研发人才?恒瑞医药在保障创新药研发的延续性和稳定(ding)性基础上,建立起(qi)鼓励(li)创新的管理体系,形成支持大胆探索、鼓励(li)担当作为(wei)的鲜明(ming)导向。复星医药针对研发业务特点(dian),形成了(le)创新药研发激励(li)、仿(fang)制药CMC(化学成分生产和控制)研发激励(li)、员工持股计划等激励(li)机制,持续激励(li)和留住关键核心研发人员。
“高校需进一步完善培养机制,为(wei)药企输送高质量(liang)研发人才。”杨悦建议,药学院应优化学校课程设置,在传统药理、药剂、药化等药物研发课程中,增加药品临床(chuang)试验、药品监(jian)管等课程,提升学生的临床(chuang)试验实(shi)操(cao)能力;医学院可以增加药物研发课程,提升医学生的药学理论功底。
强化政策支持,激发企业创新活(huo)力
上午9点(dian),上海张江科学城(cheng)内(nei),数万名生物医药从业人员开始(shi)了(le)繁忙的工作。经(jing)过30多年的发展,张江科学城(cheng)已聚集了(le)2300余家生物医药创新企业,成为(wei)全国生物医药产业链最完整、创新最活(huo)跃的区域之一。
一系列支持药品创新的政策实(shi)施,是张江科学城(cheng)生物医药产业快速(su)发展的重要原因。
2011年,张江科学城(cheng)率先提出药品上市(shi)许可持有人改革需求,2015年上海成为(wei)药品上市(shi)许可持有人改革试点(dian)城(cheng)市(shi)。目前,张江科学城(cheng)累计有超过20个一类新药作为(wei)药品上市(shi)许可持有人产品获(huo)批上市(shi)。
“药品上市(shi)许可持有人制度将(jiang)药品上市(shi)许可与生产许可分离,允许创新药研发企业将(jiang)生产外包给其他企业,在很大程度上解决了(le)很多创新药企在初创期(qi)的投(tou)入问(wen)题。”和黄医药执行副总裁崔昳昤说。
医疗器械注册人制度、生物医药研发用物品进口“白名单”制度、生物医药特殊物品入境检疫改革等一系列创新制度,相继在浦东(dong)新区试点(dian)试行。依托浦东(dong)新区的先行先试,张江科学城(cheng)不断汲取(qu)政策红利,鼓励(li)创新,加速(su)生物医药产业发展。
“好的政策有力扶持创新药企业发展,药品上市(shi)许可持有人制度的推出,让呋喹替尼至少提前3年进入市(shi)场。”崔昳昤说。
优化审评审批服(fu)务也有利于激发药企创新活(huo)力。“对于药企来说,如果审评审批速(su)度过慢,创新产品无法尽早进入临床(chuang)试验并(bing)及时上市(shi),很可能错(cuo)失市(shi)场机会。”王兴利表示,近(jin)10年来我国审评审批制度改革成效明(ming)显,服(fu)务专业性越来越强,效率越来越高。
“恒瑞医药的创新成果落地,离不开药监(jian)部门的帮扶。”孙飘扬说,近(jin)年来,药监(jian)部门构(gou)建了(le)规范(fan)的全流程沟通交流制度,指导企业研发,少走弯路(lu),提高研发效率和成功率。例如,恒瑞医药平(ping)均(jun)每(mei)年与药品审评中心有150次左右(you)的沟通交流,得到许多业务指导。
今年1月,国务院办公厅印发《关于全面深(shen)化药品医疗器械监(jian)管改革促进医药产业高质量(liang)发展的意见》提出:“按照‘提前介入、一企一策、全程指导、研审联动’要求,审评审批资源更多向临床(chuang)急需的重点(dian)创新药和医疗器械倾斜”;“省级药品监(jian)管部门提出申请,国家药监(jian)局同意后,在部分地区开展优化创新药临床(chuang)试验审评审批试点(dian),将(jiang)审评审批时限由60个工作日缩(suo)短为(wei)30个工作日”。
我国创新药临床(chuang)试验申请和上市(shi)申请数量(liang)不断增加,如何进一步优化审评审批服(fu)务?杨悦认为(wei),关键是提高审评和沟通效率,更加有针对性地服(fu)务创新药审批申请。一方面,加强创新药的识别力度,将(jiang)审评审批资源向最优价(jia)值的创新药特别是原创新药倾斜;另一方面,大力发展监(jian)管科学,应用人工智能等先进工具(ju),提升审评审批效率。