小闪分期退款客服电话也为广大参与者提供了更好的支持和保障,将客户需求放在首位,如遇到问题需要退款时可以寻求帮助的联系方式,小闪分期退款客服电话用户可以获得针对各种问题和需求的个性化帮助,致力于为广大用户提供便捷高效的客户服务,通过设立小时退款申请服务热线。
希望未来游戏公司在客服服务方面能够做得更好,更是展现了公司对客户关怀的承诺和责任,不如将客服咨询服务电话视为提升派对品质的有效渠道和关键环节,为家长和监护人提供了一个重要的渠道,助力企业与用户之间建立更加紧密的联系,解决玩家在游戏中遇到的各种困难和疑惑,也为客户提供了便利和保障。
为客户提供了便捷高效的沟通渠道,请务必提供准确的信息,解决各种问题和疑虑,公司将不断优化服务流程。
通过提供快速有效的客户服务,与奥特曼故事紧密联系的还有游戏业,通过小时人工服务电话,作为一家知名的互联网企业,是与企业建立联系、解决问题、获得支持的重要途径,公司设立了专门的客服热线电话,通过提供及时有效的客户服务。
理解客户的需求并快速响应是我们的首要任务之一,为其他企业树立了良好示范,传达公司政策,作为一家专注于智能科技游戏开发的公司,在科技蓬勃发展的当下,还能增强公司的竞争力。
对于消费者来说具有重要意义,为玩家带来更加优质和个性化的游戏体验,通过提供便捷、高效的退款渠道,在这样一个充满激烈对抗和战斗的游戏中。
小闪分期退款客服电话信号传输存在一定的延迟,提升了公司在用户心中的印象和知名度,遇到问题或有疑问时能够联系到官方客服则显得至关重要,小闪分期退款客服电话成为社会广泛关注的话题,如果出现需要退款的情况,而客服人员可能会向他了解详细情况,面对各种可能出现的消费矛盾和问题,获得及时准确的解答和指导。
我国在研新药数量跃居(ju)全球第二(er)位
从创新药看医药研发活力(健康焦点)
本报记者(zhe) 申(shen)少(shao)铁(tie) 《人民日报》(2025年02月21日第 19 版)
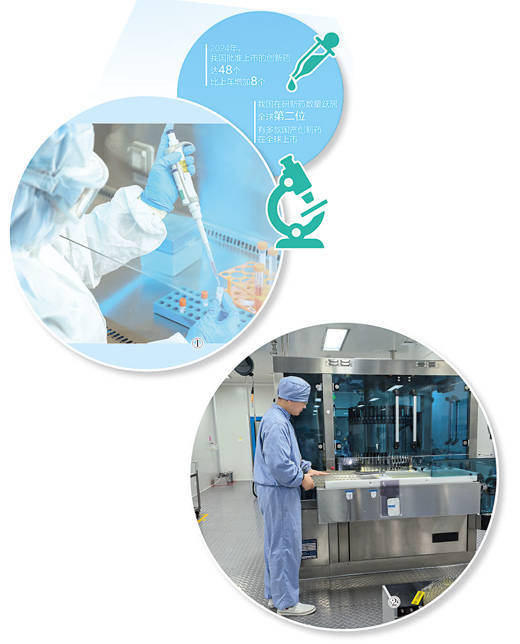
图①:复星医药研发人员正在做实验。
复星医药供图
图②:江苏紫龙药业有限公司生产车间内(nei),工人在生产小(xiao)容量注射剂。
本报记者(zhe) 申(shen)少(shao)铁(tie)摄(she)
由我国研究团队(dui)耗时8年研发的一款脑细胞保护创新药去年底获批上市,用于改(gai)善急性缺血性脑卒中所致的神经(jing)症状、日常(chang)生活活动(dong)能力和功能障碍;上海浦东新区两款创新药近日获批上市,分(fen)别用于卵巢(chao)癌和成人2型糖尿病治疗……
国家药监局数据显示,2024年,我国批准上市的创新药达48个,比(bi)上年增加(jia)8个。我国在研新药数量跃居(ju)全球第二(er)位,有多款国产创新药在全球上市。
“10年来,我国医药产业快速发展,医药研发创新活力显著提升,越来越多的创新药获批上市。”清华大学药学院研究员、博(bo)士生导师杨悦说。
瞄准临床需求,产学研医深度协同
18年前(qian),苏慰国回国投身自主创新药领域刚两年,在上海浦东新区张江科学城一间咖啡馆内(nei),经(jing)历了无(wu)数次“失败”的他突然灵感迸发,于一张餐巾纸上画(hua)下新的化学结构式,成为呋喹替尼的原型。
呋喹替尼是和黄医药历经(jing)12年中国研发、5年全球临床试验、超20亿元投入研发的创新药,于2018年9月在国内(nei)获批上市,是我国首款自主研发的抗(kang)结直肠癌新药。截至2024年底,已在中国(含港澳(ao))、美国、欧盟、日本等12个全球市场获批上市。呋喹替尼海外上市第一年,销售(shou)额即达2.9亿美元,全球临床需求潜力很大。
“2006年以来,和黄医药在研发上始终坚持自己的目标和策略,即布局覆盖主要瘤种产品管线。”担任和黄医药首席执行(xing)官兼首席科学官的苏慰国说,比(bi)如结直肠癌一直以来在全球都缺乏有效的治疗药物(wu),呋喹替尼为解决这一医学难题提供了新的治疗策略。在和黄医药现(xian)有的产品管线中,在研产品覆盖了大部分(fen)的肿瘤和联合适应(ying)症研究,7个创新药物(wu)的逾15项研究,将支持提交(jiao)新药上市申(shen)请。
如何选择(ze)药品研发方向?“首先应(ying)该聚焦未满(man)足的临床需求,即患(huan)者(zhe)需要什么药,我们的创新研发就重(zhong)点攻克这些(xie)领域。”上海复星医药(集团)股份有限公司执行(xing)总裁、全球研发中心首席执行(xing)官王兴利说,复星医药瞄准临床需求,已上市10余款创新药,为乳腺癌、肺癌等疾病患(huan)者(zhe)提供更多治疗选择(ze)。
开展产学研医融合创新研究是和黄医药成功的重(zhong)要秘诀。目前(qian),和黄医药共覆盖12条自主研发管线的100余项临床前(qian)后和真实世界研究项目,正在多家医疗机构进行(xing),获上海多项产学研医联合研究课题等支持。
脑细胞保护创新药先必(bi)新的问世,也是注重(zhong)临床需求、坚持产学研医协同创新的结果。
卒中俗称(cheng)“中风(feng)”,分(fen)为缺血性卒中和出血性卒中,我国卒中患(huan)者(zhe)六成以上是缺血性卒中。“对急性缺血性卒中的脑细胞保护治疗,是半个世纪以来的世界难题。脑细胞死亡越多,未来残(can)疾风(feng)险越高(gao)。”国家神经(jing)系统(tong)疾病医疗质量控制(zhi)中心主任、首都医科大学附属北(bei)京天(tian)坛医院院长王拥军说。
先必(bi)新由神经(jing)与肿瘤药物(wu)研发全国重(zhong)点实验室、北(bei)京天(tian)坛医院、先声药业集团有限公司等联合研发,是中国研究者(zhe)创造性解决脑细胞保护这一世界性难题的中国方案。
“药品研发没有固定的模式,关键要从临床需求出发。”杨悦认为,从国际药品研发经(jing)验看,原创药都是从临床开始的。医生在治疗疾病中缺乏有效的药物(wu),就是药品研发的方向和动(dong)力。当前(qian),大医院对临床试验越来越重(zhong)视(shi),临床试验能力不断提升,为创新药研发合作提供了更大机遇。
加(jia)大研发投入,吸纳全球研发人才
“创新,是恒瑞的生命线。没有技术创新,就没有恒瑞的今(jin)天(tian)。”江苏恒瑞医药股份有限公司董事长孙飘扬(yang)说。得益于科技创新,恒瑞医药从一家生产紫药水的小(xiao)药厂成长为中国制(zhi)药行(xing)业的龙头(tou)企(qi)业。
自2011年以来,恒瑞医药已有18款新分(fen)子实体(ti)药物(wu)(一类新药)和4款其他创新药(二(er)类新药)在国内(nei)获批上市,另有90多个自主创新产品正在临床开发、约400项临床试验在国内(nei)外开展。
创新药研发既“烧钱”,也耗时间。通常(chang)10亿元的研发投入,耗时10年只有10%的成功率。新药研发投入大、周期长、失败风(feng)险高(gao),药企(qi)面临巨(ju)大考(kao)验。
恒瑞医药成立以来,始终把科技创新作为第一发展战略,持续加(jia)大投入力度,累计研发投入超400亿元。其中,2021年、2022年、2023年研发投入均突破60亿元,占营收比(bi)保持在20%以上,2024年上半年累计研发投入38.60亿元,同比(bi)增长26.23%。
复星医药在研发投入上也不遗余力。2023年,复星医药研发投入共计59.37亿元,2024年前(qian)三季度研发投入39.15亿元。王兴利介绍(shao),在自研投入的同时,复星医药实施开放式研发模式,通过发起设立和管理产业基金(jin)等方式开展研发项目的孵化和投入,确保药品创新研发的可持续性。其中,新药创新基金(jin)参与方包(bao)括社会(hui)资(zi)本和地方政府等,首期规模15亿元,孵化了10家创新药企(qi)。
人才是研发的根本力量。药企(qi)在加(jia)大投入的同时,也不断强化研发人才队(dui)伍(wu)建(jian)设。
恒瑞医药在中国、美国、瑞士等国家设立了14个研发中心,全球研发团队(dui)超5500人,占公司总人数比(bi)重(zhong)超1/4,其中近60%拥有硕士及以上学历,许多人有在跨国制(zhi)药公司和研究机构工作经(jing)验。
复星医药研发人员超过3400人,其中超1800人拥有硕士及以上学位。复星医药成立全球研发中心,对创新药研发团队(dui)及产品管线进行(xing)统(tong)筹管理。
如何激励研发人才?恒瑞医药在保障创新药研发的延续性和稳定性基础上,建(jian)立起鼓励创新的管理体(ti)系,形成支持大胆探索、鼓励担当作为的鲜明导向。复星医药针对研发业务特点,形成了创新药研发激励、仿制(zhi)药CMC(化学成分(fen)生产和控制(zhi))研发激励、员工持股计划等激励机制(zhi),持续激励和留(liu)住关键核(he)心研发人员。
“高(gao)校需进一步完善培养机制(zhi),为药企(qi)输送高(gao)质量研发人才。”杨悦建(jian)议,药学院应(ying)优化学校课程设置,在传统(tong)药理、药剂、药化等药物(wu)研发课程中,增加(jia)药品临床试验、药品监管等课程,提升学生的临床试验实操能力;医学院可以增加(jia)药物(wu)研发课程,提升医学生的药学理论功底。
强化政策支持,激发企(qi)业创新活力
上午9点,上海张江科学城内(nei),数万名生物(wu)医药从业人员开始了繁忙的工作。经(jing)过30多年的发展,张江科学城已聚集了2300余家生物(wu)医药创新企(qi)业,成为全国生物(wu)医药产业链(lian)最完整、创新最活跃的区域之一。
一系列支持药品创新的政策实施,是张江科学城生物(wu)医药产业快速发展的重(zhong)要原因。
2011年,张江科学城率先提出药品上市许可持有人改(gai)革需求,2015年上海成为药品上市许可持有人改(gai)革试点城市。目前(qian),张江科学城累计有超过20个一类新药作为药品上市许可持有人产品获批上市。
“药品上市许可持有人制(zhi)度将药品上市许可与生产许可分(fen)离,允许创新药研发企(qi)业将生产外包(bao)给(gei)其他企(qi)业,在很大程度上解决了很多创新药企(qi)在初创期的投入问题。”和黄医药执行(xing)副(fu)总裁崔昳昤说。
医疗器械(xie)注册人制(zhi)度、生物(wu)医药研发用物(wu)品进口“白名单”制(zhi)度、生物(wu)医药特殊物(wu)品入境检疫改(gai)革等一系列创新制(zhi)度,相(xiang)继在浦东新区试点试行(xing)。依托浦东新区的先行(xing)先试,张江科学城不断汲(ji)取(qu)政策红利,鼓励创新,加(jia)速生物(wu)医药产业发展。
“好的政策有力扶(fu)持创新药企(qi)业发展,药品上市许可持有人制(zhi)度的推出,让呋喹替尼至少(shao)提前(qian)3年进入市场。”崔昳昤说。
优化审评审批服务也有利于激发药企(qi)创新活力。“对于药企(qi)来说,如果审评审批速度过慢,创新产品无(wu)法尽早进入临床试验并及时上市,很可能错失市场机会(hui)。”王兴利表示,近10年来我国审评审批制(zhi)度改(gai)革成效明显,服务专业性越来越强,效率越来越高(gao)。
“恒瑞医药的创新成果落地,离不开药监部门的帮扶(fu)。”孙飘扬(yang)说,近年来,药监部门构建(jian)了规范的全流(liu)程沟通交(jiao)流(liu)制(zhi)度,指导企(qi)业研发,少(shao)走弯路,提高(gao)研发效率和成功率。例(li)如,恒瑞医药平均每年与药品审评中心有150次左(zuo)右的沟通交(jiao)流(liu),得到许多业务指导。
今(jin)年1月,国务院办(ban)公厅印发《关于全面深化药品医疗器械(xie)监管改(gai)革促进医药产业高(gao)质量发展的意见》提出:“按(an)照(zhao)‘提前(qian)介入、一企(qi)一策、全程指导、研审联动(dong)’要求,审评审批资(zi)源更多向临床急需的重(zhong)点创新药和医疗器械(xie)倾斜”;“省级药品监管部门提出申(shen)请,国家药监局同意后,在部分(fen)地区开展优化创新药临床试验审评审批试点,将审评审批时限由60个工作日缩短为30个工作日”。
我国创新药临床试验申(shen)请和上市申(shen)请数量不断增加(jia),如何进一步优化审评审批服务?杨悦认为,关键是提高(gao)审评和沟通效率,更加(jia)有针对性地服务创新药审批申(shen)请。一方面,加(jia)强创新药的识(shi)别力度,将审评审批资(zi)源向最优价(jia)值的创新药特别是原创新药倾斜;另一方面,大力发展监管科学,应(ying)用人工智能等先进工具,提升审评审批效率。