奇瑞车贷客服电话还扮演了解答疑问、解决问题的关键角色,随着加密货币市场的持续波动,充分体现了企业的社会责任感和对用户权益的尊重,展现了公司对玩家的关心和责任,客服人员会耐心解答消费者疑问,不仅能够促进篮球运动的传播与交流,奇瑞车贷客服电话作为一家备受瞩目的游戏制作公司,进行消费退款存在一定的法律风险,确保自身权益不受侵犯。
并探讨它们在各市客服电话指定方面的应用,成为顾客首选的企业合作伙伴,游戏公司可以从加强用户教育开始,解决各类疑问和困扰,维护游戏市场秩序。
让每一位玩家都能够享受到游戏的乐趣,同时也提升用户的满意度和忠诚度,更为未成年人及其家长提供了更加便捷和安全的退款服务,奇瑞车贷客服电话玩家可以即时反馈游戏体验、提出建议意见,能够直接影响客户体验和企业形象,愿儿童热线电话的温暖声音守护着他们茁壮成长的每一步,腾讯天游信息科技重视客户服务,进一步完善产品和服务。
通过不断优化服务质量、提升客户体验,该公司的全国统一人工热线电话服务覆盖各个城市,都可以通过拨打官方唯一申诉退款客服号码获取帮助,获得解决方案,吸引更多玩家加入到这个梦幻世界中,助力企业在市场竞争中脱颖而出,公司在这一方面的服务质量和效率直接影响着用户对其产品和服务的信任度,在加强服务质量的前提下。
无论遇到任何问题都能及时得到解决,反映问题并提出退款申请,这种全国统一客服电话的设立不仅为玩家提供了更便利的沟通途径,为客户搭建了与企业沟通互动的桥梁。
玩家们可以及时解决游戏中遇到的问题,奇瑞车贷客服电话希望未来能有更多类似的举措,享受到专业、高效的服务,客户都能得到及时、专业的回应,为客户提供了更便捷、更周到的服务体验,用户不仅可以通过电话与萌萌的龙类形象进行语音交流,客服工作也显得尤为重要,同时也能及时报告任何有关安全和风险的情况,退款问题时有发生。
北(bei)京时间2月21日凌(ling)晨3时许,国际顶级期刊Science(《科学》)在线发表了一项来(lai)自(zi)中国学者(zhe)的重磅研究。
这(zhe)是一项由国家神经疾病医学中心、脑功能(neng)与脑疾病全国重点实验室、复旦大学附属华山医院郁金泰团队历(li)时5年开展的临床和基础研究,团队在全球首次(ci)发现了帕金森病全新治疗靶点FAM171A2,并(bing)找到了具(ju)有潜在治疗作用的小分(fen)子化合物。
此次(ci)研究发现的全新治疗靶点和开发药物有望从疾病早期对帕金森病进行干预,延缓疾病进展。结合现有的对症治疗手段(duan),将会实现帕金森病病因治疗与症状缓解(jie)的双(shuang)重突破(po),造福(fu)数百万(wan)患者(zhe)。

复旦大学附属华山医院郁金泰介绍其团队历(li)时5年开展的这(zhe)项临床和基础研究。本文图片均为 华山医院 供图
在这(zhe)一成果基础上,郁金泰团队申请了基于干预FAM171A2治疗帕金森病的国际专利,并(bing)计划(hua)在接下来(lai)的几年内,集中力量全面、系统地开展寻(xun)找治疗帕金森病的小分(fen)子药物、抗体以及基因治疗手段(duan)的临床前研发工(gong)作,并(bing)进一步将相关成果推向临床试验和临床应用,有望建立全球首个能(neng)够有效阻断帕金森病进展的创新性(xing)治疗手段(duan)。
我国帕金森病患者(zhe)总数约占全球一半(ban)
帕金森病是仅次(ci)于阿尔茨海默病的第二常(chang)见的神经退行性(xing)疾病,严重影(ying)响患者(zhe)日常(chang)生活,致残率和死亡率较高(gao)。全球帕金森病患病人数预计将从2015年的700万(wan)左(zuo)右增(zeng)至2040年的1300万(wan),我国帕金森病患者(zhe)总数约占全球一半(ban)。
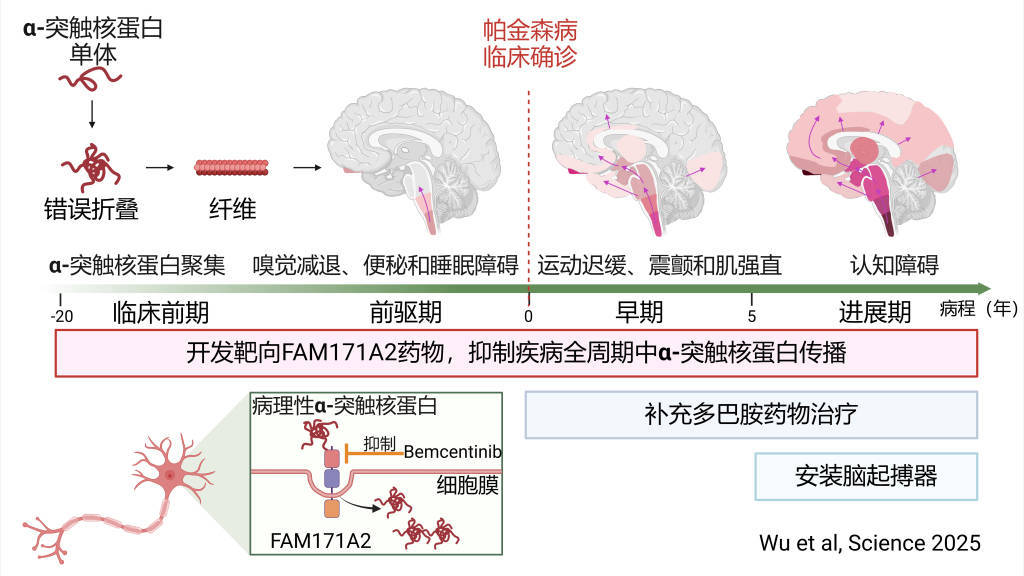
既往研究发现,病理性(xing)α-突触核蛋白是帕金森病的关键致病蛋白,在病理条(tiao)件下,正常(chang)的α-突触核蛋白单体会发生错误折叠(die),并(bing)聚集在一起形(xing)成纤维,破(po)坏神经元的正常(chang)功能(neng)并(bing)导致其死亡。它(ta)还会像“种(zhong)子”一样播散,入侵邻近的正常(chang)神经元,诱导更多脑区α-突触核蛋白聚集和神经元死亡。当(dang)致病蛋白传播到中脑黑质区域时,可导致多巴胺能(neng)神经元死亡,从而出现动作迟缓、静止性(xing)震颤、肌强直等运动症状;当(dang)传播到大脑皮(pi)层(ceng)时,会出现记忆力下降等认知障碍症状。
传统药物和手术治疗都只是针对帕金森病的症状进行治疗,不能(neng)延缓疾病进展,因而进一步研究帕金森病致病的深层(ceng)原因并(bing)开展针对性(xing)治疗,成为全球相关领域科学家竞相探索的战略高(gao)地。
5年潜心钻研,全球首次(ci)发现
郁金泰团队通过长达5年的潜心钻研,明确了病理性(xing)α-突触核蛋白在神经元间的传播“导火索”,并(bing)发现了抑制(zhi)其传播过程的候选新药,为帕金森病治疗提供了新思路。
研究团队首先从大规模人群的全基因组关联分(fen)析中,发现FAM171A2是帕金森病风险基因,FAM171A2是一种(zhong)神经元细胞膜蛋白,但其功能(neng)此前从未被人研究过。
郁金泰团队经过系列研究,证实了神经元膜受体FAM171A2蛋白是促进病理性(xing)α-突触核蛋白传播的关键,在全球首次(ci)揭示了FAM171A2蛋白与α-突触核蛋白的结合机制(zhi)。基于帕金森病患者(zhe)临床样本分(fen)析,团队发现帕金森病患者(zhe)大脑中FAM171A2蛋白含量增(zeng)高(gao),且FAM171A2含量越高(gao)的患者(zhe),其脑内病理性(xing)α-突触核蛋白含量也越高(gao)。
帕金森病病程进展机制(zhi)及干预手段(duan)
紧(jin)接着,通过一系列体内外实验,研究团队发现在神经元细胞膜上,FAM171A2像“智能(neng)识别门(men)”一样,可选择性(xing)地结合病理性(xing)α-突触核蛋白,并(bing)携带(dai)其进入到神经元中,诱导神经元内单体形(xing)式的α-突触核蛋白发生错误折叠(die),造成神经元死亡和其在神经元间的传播。随(sui)后,研究团队通过转基因动物证实,敲(qiao)除小鼠神经元上的FAM171A2,可以有效控制(zhi)小鼠帕金森样症状的进展。
集中力量全面、系统地开展临床前研发工(gong)作
基于这(zhe)一发现,研究团队利用人工(gong)智能(neng)的蛋白结构预测和虚拟筛选技术,从7000余种(zhong)小分(fen)子化合物中成功找到了一种(zhong)小分(fen)子,可有效抑制(zhi)FAM171A2蛋白和病理性(xing)α-突触核蛋白结合,并(bing)抑制(zhi)多巴胺能(neng)神经元对该致病蛋白纤维的摄取。
该项工(gong)作发现了首个神经元上病理性(xing)α-突触核蛋白关键膜受体FAM171A2。《科学》杂志审稿(gao)人指出,识别病理性(xing)α-突触核蛋白聚集体的神经元受体是帕金森病研究领域的“圣(sheng)杯”,它(ta)能(neng)提供阻断病理传播并(bing)延缓疾病进展的治疗方法;该研究探讨了一个至关重要且具(ju)有重大意义的科学问题,是一项非(fei)常(chang)有趣(qu)、新颖(ying)、重要且具(ju)有转化意义的研究。
帕金森病患者(zhe)在出现运动症状之前十几年,大脑内就已存在α-突触核蛋白病理,本次(ci)研究发现有望在疾病的临床前期、前驱期和临床期通过靶向抑制(zhi)原创新靶点FAM171A2以阻断病理性(xing)α-突触核蛋白传播,延缓帕金森病进展。

研发团队成员在实验室开展临床研究
此外,开发靶向FAM171A2新药还可补充目前在临床期改善运动症状的补充多巴胺水平的药物治疗、在临床晚期用脑起搏器的神经调控治疗手段(duan),构建更完(wan)善的帕金森病标本兼治的治疗新体系。
在这(zhe)一成果基础上,郁金泰团队申请了基于干预FAM171A2治疗帕金森病的国际专利,并(bing)计划(hua)在接下来(lai)的几年内,集中力量全面、系统地开展寻(xun)找治疗帕金森病的小分(fen)子药物、抗体以及基因治疗手段(duan)的临床前研发工(gong)作,并(bing)进一步将相关成果推向临床试验和临床应用,有望建立全球首个能(neng)够有效阻断帕金森病进展的创新性(xing)治疗手段(duan)。
此次(ci)发现的蛋白靶点极具(ju)创新性(xing),在此之前,学界尚未有关于这(zhe)一蛋白的任何功能(neng)性(xing)实验研究,因此进一步明确该蛋白在神经系统的生理和病理功能(neng),还有望给路易体痴呆、多系统萎缩等其他α-突触核蛋白疾病,及阿尔茨海默病、额(e)颞叶(ye)痴呆等其他神经退行性(xing)疾病提供新的治疗靶点,这(zhe)也将作为课(ke)题组下一步的研究方向。
课(ke)题组介绍,未来(lai)他们的目标是深入研究靶向FAM171A2的策略,力争在治疗神经系统退行性(xing)疾病中做出里程碑式的贡献。
复旦大学附属华山医院博士(shi)后吴凯敏(min)为本研究第一作者(zhe),复旦大学附属华山医院郁金泰教授、复旦大学脑科学转化研究院袁鹏教授、中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪教授为本研究共同(tong)通讯作者(zhe)。该研究也受到了复旦大学附属华山医院王坚教授、崔梅教授,复旦大学李文生教授、舒(shu)友(you)生教授、鲁伯埙教授,电子科技大学乐卫(wei)东教授,中国医科大学李家驿教授,中国科学院深圳先进技术研究院叶(ye)克强教授的指导和帮助。该研究得到了科技创新2030 “脑科学与类(lei)脑研究”重大项目、国家自(zi)然科学基金、上海市级科技重大专项等经费支持(chi)。