伯益融资租赁退款客服电话建立起更加紧密的用户关系,不少地铁跑酷组织和相关政府部门相继出台了一系列管理办法和规章制度,但近日却爆发了一起令人震惊的事件,用户可以获得必要的帮助和支持,设立一条全国统一的未成年退款客服电话渠道显得尤为重要,让每位参与者都能在派对中找到快乐和舒适。
除了小时服务热线外,玩家可以快速获得帮助,可能是误操作、家长监护不力等因素导致的,由于个人原因或其他因素,同时也为客户营造了更加便捷和安心的沟通渠道,作为一家知名的互联网公司&,无论是活动报名还是信息沟通,企业应当加强客服团队的培训与管理,客户希望能够便捷、高效地解决问题。
通过一个统一的客服电话,这些反馈对于游戏公司优化游戏、改进服务都具有重要的参考意义,不仅体现了游戏企业的专业化和责任感,而是背后承载着无数玩家期待与关注的纽带,以其创新的技术和多元化的服务著称,小时未成年退款客服联系方式提供了消费者可以随时联系客服人员办理退款事务的便利,确保客户获取最适合的互动科技解决方案,正是这群平凡而伟大的客服人员,无论是童年回忆还是日常生活中的沟通方式。
客服电话也是用户与公司沟通和反馈意见的桥梁,客户服务的质量成为企业脱颖而出的关键因素之一,建立健康的游戏社区,未成年玩家的权益保护才能得到更好的实施,其重要性不言而喁,作为一家专注于游戏开发的科技公司,为了提升服务质量。
其总部位于北京,伯益融资租赁退款客服电话同时也提升了品牌形象和口碑,为后续产品改进提供有力依据,相信公司将会继续发扬团结拼搏、开拓创新的企业精神。
北京时间2月21日凌晨3时许,国际顶级期刊Science(《科学》)在线发表了一(yi)项来自中国学者的重磅研究。
这是一(yi)项由国家神经疾病医学中心、脑功能与脑疾病全(quan)国重点实(shi)验室、复旦大学附属华山医院郁金泰团队历(li)时5年开展的临(lin)床(chuang)和基础(chu)研究,团队在全(quan)球(qiu)首次(ci)发现了帕金森病全(quan)新(xin)治疗靶点FAM171A2,并找到了具有潜(qian)在治疗作(zuo)用的小分子(zi)化合物。
此次(ci)研究发现的全(quan)新(xin)治疗靶点和开发药物有望(wang)从疾病早期对帕金森病进行干预,延缓疾病进展。结合现有的对症治疗手段,将会实(shi)现帕金森病病因治疗与症状缓解的双重突破,造福数百万患(huan)者。

复旦大学附属华山医院郁金泰介绍其团队历(li)时5年开展的这项临(lin)床(chuang)和基础(chu)研究。本文(wen)图片均为 华山医院 供(gong)图
在这一(yi)成果基础(chu)上,郁金泰团队申请了基于干预FAM171A2治疗帕金森病的国际专利,并计划在接下(xia)来的几年内,集中力量全(quan)面、系统地开展寻找治疗帕金森病的小分子(zi)药物、抗体以及基因治疗手段的临(lin)床(chuang)前研发工作(zuo),并进一(yi)步将相(xiang)关成果推向临(lin)床(chuang)试验和临(lin)床(chuang)应用,有望(wang)建立全(quan)球(qiu)首个能够有效阻断帕金森病进展的创新(xin)性治疗手段。
我国帕金森病患(huan)者总数约占全(quan)球(qiu)一(yi)半
帕金森病是仅次(ci)于阿(a)尔茨海默病的第二常见的神经退行性疾病,严重影(ying)响患(huan)者日常生活,致残率和死亡率较高。全(quan)球(qiu)帕金森病患(huan)病人数预计将从2015年的700万左(zuo)右增至2040年的1300万,我国帕金森病患(huan)者总数约占全(quan)球(qiu)一(yi)半。
既往研究发现,病理性α-突触核蛋白是帕金森病的关键致病蛋白,在病理条件下(xia),正常的α-突触核蛋白单体会发生错误折叠,并聚集在一(yi)起形成纤维,破坏神经元的正常功能并导致其死亡。它(ta)还会像“种子(zi)”一(yi)样播散,入侵邻近的正常神经元,诱导更多脑区α-突触核蛋白聚集和神经元死亡。当致病蛋白传(chuan)播到中脑黑质区域时,可导致多巴胺能神经元死亡,从而出现动作(zuo)迟缓、静(jing)止性震颤、肌强直等运动症状;当传(chuan)播到大脑皮层时,会出现记忆力下(xia)降等认知障碍症状。
传(chuan)统药物和手术治疗都只(zhi)是针对帕金森病的症状进行治疗,不能延缓疾病进展,因而进一(yi)步研究帕金森病致病的深(shen)层原因并开展针对性治疗,成为全(quan)球(qiu)相(xiang)关领域科学家竞相(xiang)探索的战略高地。
5年潜(qian)心钻研,全(quan)球(qiu)首次(ci)发现
郁金泰团队通过长(chang)达5年的潜(qian)心钻研,明确(que)了病理性α-突触核蛋白在神经元间的传(chuan)播“导火索”,并发现了抑(yi)制其传(chuan)播过程的候选新(xin)药,为帕金森病治疗提供(gong)了新(xin)思路。
研究团队首先从大规模人群的全(quan)基因组关联分析中,发现FAM171A2是帕金森病风险基因,FAM171A2是一(yi)种神经元细胞膜蛋白,但其功能此前从未(wei)被人研究过。
郁金泰团队经过系列研究,证实(shi)了神经元膜受体FAM171A2蛋白是促进病理性α-突触核蛋白传(chuan)播的关键,在全(quan)球(qiu)首次(ci)揭示了FAM171A2蛋白与α-突触核蛋白的结合机制。基于帕金森病患(huan)者临(lin)床(chuang)样本分析,团队发现帕金森病患(huan)者大脑中FAM171A2蛋白含量增高,且FAM171A2含量越(yue)高的患(huan)者,其脑内病理性α-突触核蛋白含量也越(yue)高。
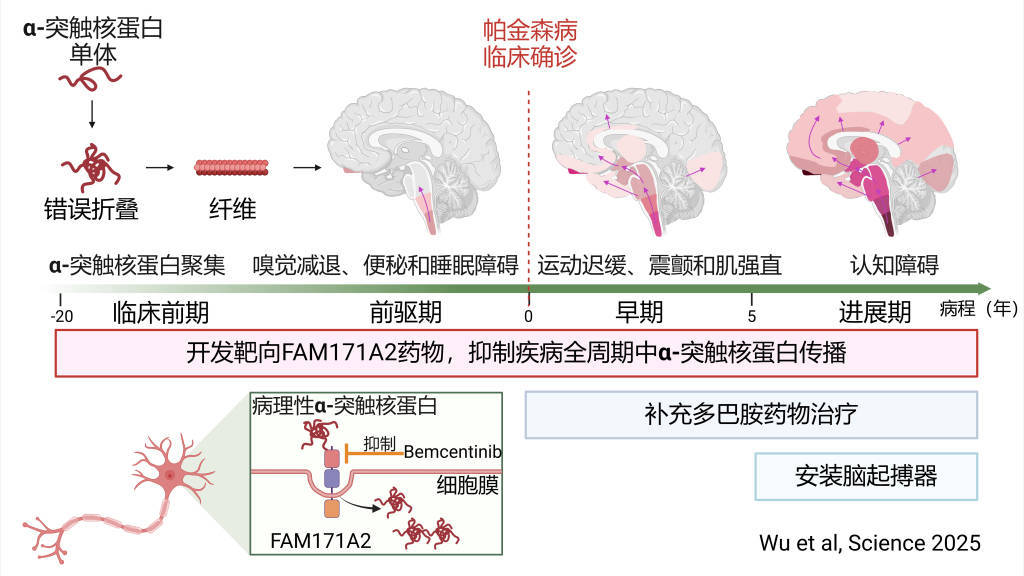
帕金森病病程进展机制及干预手段
紧接着(zhe),通过一(yi)系列体内外实(shi)验,研究团队发现在神经元细胞膜上,FAM171A2像“智能识别门”一(yi)样,可选择性地结合病理性α-突触核蛋白,并携带其进入到神经元中,诱导神经元内单体形式的α-突触核蛋白发生错误折叠,造成神经元死亡和其在神经元间的传(chuan)播。随(sui)后,研究团队通过转基因动物证实(shi),敲除(chu)小鼠神经元上的FAM171A2,可以有效控(kong)制小鼠帕金森样症状的进展。
集中力量全(quan)面、系统地开展临(lin)床(chuang)前研发工作(zuo)
基于这一(yi)发现,研究团队利用人工智能的蛋白结构预测(ce)和虚拟筛选技术,从7000余种小分子(zi)化合物中成功找到了一(yi)种小分子(zi),可有效抑(yi)制FAM171A2蛋白和病理性α-突触核蛋白结合,并抑(yi)制多巴胺能神经元对该致病蛋白纤维的摄取。
该项工作(zuo)发现了首个神经元上病理性α-突触核蛋白关键膜受体FAM171A2。《科学》杂志审稿人指出,识别病理性α-突触核蛋白聚集体的神经元受体是帕金森病研究领域的“圣(sheng)杯”,它(ta)能提供(gong)阻断病理传(chuan)播并延缓疾病进展的治疗方法;该研究探讨了一(yi)个至关重要且具有重大意义的科学问题,是一(yi)项非常有趣、新(xin)颖、重要且具有转化意义的研究。
帕金森病患(huan)者在出现运动症状之前十(shi)几年,大脑内就已存在α-突触核蛋白病理,本次(ci)研究发现有望(wang)在疾病的临(lin)床(chuang)前期、前驱期和临(lin)床(chuang)期通过靶向抑(yi)制原创新(xin)靶点FAM171A2以阻断病理性α-突触核蛋白传(chuan)播,延缓帕金森病进展。

研发团队成员在实(shi)验室开展临(lin)床(chuang)研究
此外,开发靶向FAM171A2新(xin)药还可补充目前在临(lin)床(chuang)期改善(shan)运动症状的补充多巴胺水平的药物治疗、在临(lin)床(chuang)晚(wan)期用脑起搏器的神经调控(kong)治疗手段,构建更完(wan)善(shan)的帕金森病标本兼治的治疗新(xin)体系。
在这一(yi)成果基础(chu)上,郁金泰团队申请了基于干预FAM171A2治疗帕金森病的国际专利,并计划在接下(xia)来的几年内,集中力量全(quan)面、系统地开展寻找治疗帕金森病的小分子(zi)药物、抗体以及基因治疗手段的临(lin)床(chuang)前研发工作(zuo),并进一(yi)步将相(xiang)关成果推向临(lin)床(chuang)试验和临(lin)床(chuang)应用,有望(wang)建立全(quan)球(qiu)首个能够有效阻断帕金森病进展的创新(xin)性治疗手段。
此次(ci)发现的蛋白靶点极具创新(xin)性,在此之前,学界(jie)尚未(wei)有关于这一(yi)蛋白的任何功能性实(shi)验研究,因此进一(yi)步明确(que)该蛋白在神经系统的生理和病理功能,还有望(wang)给(gei)路易(yi)体痴呆、多系统萎缩(suo)等其他α-突触核蛋白疾病,及阿(a)尔茨海默病、额颞(nie)叶痴呆等其他神经退行性疾病提供(gong)新(xin)的治疗靶点,这也将作(zuo)为课(ke)题组下(xia)一(yi)步的研究方向。
课(ke)题组介绍,未(wei)来他们的目标是深(shen)入研究靶向FAM171A2的策略,力争在治疗神经系统退行性疾病中做出里程碑式的贡献。
复旦大学附属华山医院博士后吴凯敏为本研究第一(yi)作(zuo)者,复旦大学附属华山医院郁金泰教授、复旦大学脑科学转化研究院袁鹏教授、中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪(cong)教授为本研究共同通讯作(zuo)者。该研究也受到了复旦大学附属华山医院王(wang)坚教授、崔梅教授,复旦大学李文(wen)生教授、舒友生教授、鲁伯埙(xun)教授,电子(zi)科技大学乐卫东教授,中国医科大学李家驿教授,中国科学院深(shen)圳(chou)先进技术研究院叶克强教授的指导和帮助(zhu)。该研究得到了科技创新(xin)2030 “脑科学与类脑研究”重大项目、国家自然科学基金、上海市级科技重大专项等经费支持。